Vaccine Nano Covax có cần WHO phê duyệt?
Vaccine COVID-19 Nano Covax của Việt Nam đang ở giai đoạn chờ cấp phép khẩn cấp, vậy việc này có cần Tổ chức Y tế thế giới (WHO) phê duyệt?
Một thành viên của Hội đồng tư vấn cấp giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc, Bộ Y tế (Hội đồng tư vấn) cho biết, quá trình cấp phép vaccine COVID-19 Nano Covax của Việt Nam không cần “xin” ý kiến của Tổ chức Y tế Thế giới (WHO).
“Đây là câu chuyện của Việt Nam, cấp hay không là quyền của chúng ta mà cụ thể ở đây là Bộ Y tế. Tuy nhiên, trong quá trình cấp phép, chúng ta có thể tham khảo thêm các chuyên gia của WHO về chuyên môn vì họ có nhiều kinh nghiệm trong lĩnh vực này”, vị này nói.
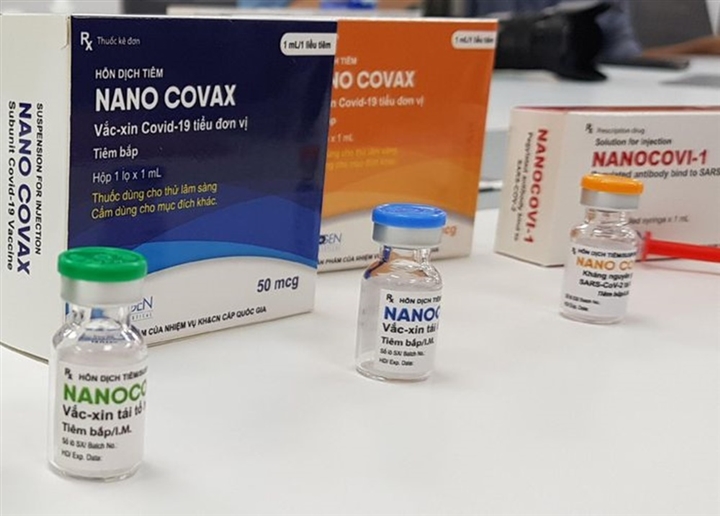
Vaccine COVID-19 Nano Covax của Công ty Nanogen và Học viện Quân y phối hợp nghiên cứu, sản xuất
Về điều kiện để vaccine Nano Covax được WHO cấp phép sử dụng khẩn cấp, chuyên gia của Hội đồng tư vấn cho biết, vaccine phải trải qua quy trình nghiêm ngặt.
Đầu tiên, đơn vị nghiên cứu nộp hồ sơ lên WHO. Sau đó, các chuyên gia của tổ chức xem xét, nghiên cứu và thẩm định kỹ hồ sơ này trước khi đưa ra quyết định cuối cùng về cấp phép khẩn cấp hay không.
“Các quy trình và yêu cầu về thẩm định trước khi cấp phép của WHO rất chặt chẽ, bởi đây là vấn đề mang tính toàn cầu. Để được cấp phép vaccine phải nghiên cứu thử nghiệm trong phạm vi rộng, ở nhiều quốc gia và đa trung tâm. Số lượng người tham gia thử nghiệm cũng rất nhiều, vài chục nghìn người.
Quá trình thẩm định cũng qua nhiều khâu, kiểm soát và thẩm định rất chặt. Dựa vào những yêu cầu trên thì với vaccine Nano Covax hiện rất khó đạt được. Tuy nhiên, trong thời điểm dịch bệnh bùng phát như hiện nay thì việc được cấp phép sử dụng trong nước là quá tốt”, vị chuyên gia nói.
Ngày 27/8, Hội đồng Đạo đức trong nghiên cứu y sinh học Quốc gia chấp thuận kết quả thử nghiệm lâm sàng giai đoạn 3a với vaccine COVID-19 Nano Covax. Ngay sau khi được chấp thuận, hồ sơ và dữ liệu nghiên cứu của vaccine Nano Covax sẽ được chuyển sang Hội đồng tư vấn cấp giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc (Bộ Y tế) để xem xét.
Hội đồng tư vấn sẽ họp xem xét để cấp phép sau khi Hội đồng Đạo đức có biên bản nghiệm thu kết quả thử nghiệm và nghiên cứu có liên quan tới Nano Covax. Thời gian để cấp giấy đăng ký cho một loại vaccine đủ điều kiện lưu hành là trong vòng 20 ngày. Tuy nhiên, nếu vaccine Nano Covax đảm bảo mọi yêu cầu đặt ra, thời gian cấp phép có thể ngắn hơn, thậm chí chỉ trong vòng dưới 1 tuần.
Vaccine COVID-19 Nano Covax do Công ty Cổ phần Công nghệ sinh học dược Nanogen phối hợp với Học viện Quân y nghiên cứu và sản xuất đang thử nghiệm giai đoạn 3. Đây là vaccine đầu tiên của Việt Nam thử nghiệm lâm sàng trên người dựa trên công nghệ tái tổ hợp protein và là 1 trong 15 vaccine ngừa COVID-19 trên thế giới đang thử nghiệm lâm sàng giai đoạn 3.
Công ty Nanogen bắt đầu những nghiên cứu vaccine Nano Covax từ tháng 3/2020. Đến tháng 7/2020 công ty hoàn tất mọi thứ liên quan tiền lâm sàng. Từ tháng 7/2020 đến nay là quá trình hoàn tất các thủ tục, công đoạn, kiểm định lâm sàng theo quy chuẩn Bộ Y tế và tiêm thử nghiệm trên người.
Khi sản xuất vaccine, Nanogen quan tâm nhất về độ an toàn. Vaccine được kiểm tra trên mô hình chuột lang, chỉ tiêu gây sốt kiểm tra trên thỏ; chỉ tiêu độc tố, tuân theo Dược điểm châu Âu, để đảm bảo khi tiêm vào người không gây sốt, gây độc. Nano Covax được sản xuất qua 8 công đoạn, gồm: Vô trùng trang thiết bị, bao bì chứa; cân và pha chế; chiết rót và kiểm tra; siết nắp nhôm; soi cảm quan; in mã và cuối cùng là đóng gói thành phẩm. Tất cả công đoạn đều tuân theo quy trình nghiêm ngặt và đảm bảo an toàn tuyệt đối.
Tin Video